【抗乳癌3】歐洲女患者_牛樟芝應用在乳癌骨轉移的治療效果_Antrodia cinnamomea is a potential adjuvant therapy against breast cancer with bone metastasis
論文發表在歐洲國際期刊: Medicine
牛樟芝(Antrodia cinnamomea,簡稱AC)是一種藥用真菌,是台灣著名的民間藥物,具有眾多藥用特性,在保肝與抗癌相關效果顯著。特別是抗腫瘤,牛樟芝已累積超過500篇體外和體內抗癌國際研究,例如促進癌細胞凋亡或自噬和細胞週期阻滯、抑制癌細胞遷移、抗血管生成和抗炎等方面,證明它的抗癌作用來自於多種生物活性化合物的協同作用,每種化合物負責其特定的靶標或調節特定的信號通路。
下面是一篇2020年由慈濟醫院、慈濟大學藥學系、東華、斯洛維尼亞Ljubljana大學醫學中心共同發表在歐洲國際期刊: Medicine《醫學》關於乳癌轉移患者的個案研究,是第一篇研究發現牛樟芝對轉移性乳癌患者具有增強輔助治療的效果。

1.個案摘要:
一位歐洲斯洛維尼亞(Slovenia) 50歲女性被診斷出患有乳腺癌(Breast cancer)的骨轉移復發病症,患者因恐懼而拒絕手術治療,因為害怕副作用會造成身體不舒服與痛苦,並犧牲原有的生活品質,也拒絕了放療與化療。在本個案研究中,我們評估了牛樟芝 聯合PAL、FUL兩種輔助治療藥物對一名轉移性乳癌患者的治療效果。
1-1 診斷:
患者為乳腺癌第四期,原為HR陽性/ HER2陰性的乳腺癌(Breast cancer),後來復發並出現了骨轉移。
1-2 治療措施:
在診斷出骨轉移復發後,她接受了PAL、FUL的輔助治療藥物。此外,她選擇口服牛樟芝(每天10克)。
【補充說明】PAL(Palbociclib)是細胞分裂週期的抑制劑;FUL(fulvestrant)是一種抗雌激素藥物。PAL常與FUL聯合用於輔助治療HR陽性/ HER2陰性的轉移性乳癌(MBC)病患。當停經後轉移性乳癌患者對第一線抗雌激素藥物(如:泰莫西芬)有抗藥性時,可使用美國FDA核准的FUL做為第二線用藥。
1-3 結果:
疼痛大部分得到緩解,且減少輔助治療藥物(PAL、FUL)的副作用。磁共振成像顯示,在接受輔助治療搭配牛樟芝後的第五個月,腫瘤減小了。在接受輔助治療搭配牛樟芝 14個月後,胸椎T1和T3的腫瘤顯著縮小,T1腫瘤從35.2mm縮小至28.1mm。T3腫瘤從12.0mm縮小至9.9mm。值得注意的是,沒有發現進一步的轉移。
2.個案研究內容
2-1 第一次發現乳癌
2012年4月(簡寫為2012/4),一名50歲女性接受了常規乳房X光攝影檢查,發現右乳腺外側上方一個大小為24 x 23 x 21 mm的腫瘤。經活體組織切片檢查發現是多灶性侵襲性乳管癌。腫瘤被分期為T0N0M0(II期,ER 100%,PR 90%陽性,HER2陰性)。所有血液和癌症指標(CEA和CA15-3)的檢測結果均在正常範圍內。2012/5,進行了乳腺部分切除術以確保沒有淋巴結轉移。她最初接受了22 x 2(Gy)的放射治療,另於2012/9進行5 x 2 Gy放射治療。由於有子宮內膜異位症病史,她拒絕了使用tamoxifen (泰莫西芬)的賀爾蒙輔助療法,定期採乳房X光攝影和腫瘤標記物測試進行定期追蹤。這些追蹤未發現疾病進展的跡象。
【補充說明】
CEA (癌胚抗原, carcinoembryonic antigen)是最常使用的癌症指標,可用來監測癌症的病情進展及治療後是否復發。
CA15-3 (癌抗原15-3, carcinoma antigen 15-3) CA-153異常偏高可能是原發性乳癌。
2-2 出現骨轉移
2016/9,由於左臂劇烈疼痛,她接受了脊柱電腦斷層掃描(CT)與磁振造影(MRI)。MRI檢查顯示癌細胞轉移脊椎T1。然而,未觀察到其他器官或骨頭的轉移。此外,血液測試結果和CA15-3水平仍在正常範圍內。醫生建議採賀爾蒙輔助療法,但患者擔心副作用會犧牲原有生活品質,她再次拒絕接受輔助療法。從2016/10 – 2017/3,她選擇每天服用一次牛樟芝4g (克)以維持自己的健康狀況。2017/5-6,CT和MRI持續定期追蹤患者狀況。2017/7,CA15-3水平仍在正常範圍內。然而,腫瘤標記物CEA水平升高(4.6 μg / L),超出了上限(4.0 μg / L)。
2-3 兩處骨轉移腫瘤
2018/2,由於脊髓壓迫引起的右臂劇烈疼痛,她再次接受了頸椎MRI檢查。MRI報告顯示胸椎有兩個骨轉移腫瘤,分別是T2左側有一個腫瘤(最大尺寸為35.2 mm)。另外T3右側有另一個腫瘤(最大尺寸為12.0 mm)。
(1)僅接受輔助療法,拒絕手術、放療與化療
患者因為害怕副作用而拒絕了手術、放療與化療。2018/3,陸續開始使用輔助治療藥物FUL 500mg和PAL 125mg。
(2) PAL、FUL副作用強烈
在FUL注射後的第一週出現明顯的副作用,包括背痛、關節和肌肉疼痛、腿部疼痛、手術部位頸部燒灼感、下腹部燒灼感、潮紅和虛弱。早上手顫讓她非常沮喪。在PAL注射後,也出現了明顯的副作用,如貧血、神經病變、牙齦出血、頭髮變薄或脫落、呼吸急促,有時還會心跳加速。
由於FUL注射引起的肝毒性, ALT(肝發炎指數)升高的情況。也注意到因FUL和PAL注射引起的血液和淋巴系統功能失調,如血小板減少症、中性粒細胞減少症、白細胞減少症和貧血,以及免疫系統功能失調,如過敏反應。
(3)加入牛樟芝改善,檢測數值漸趨穩定
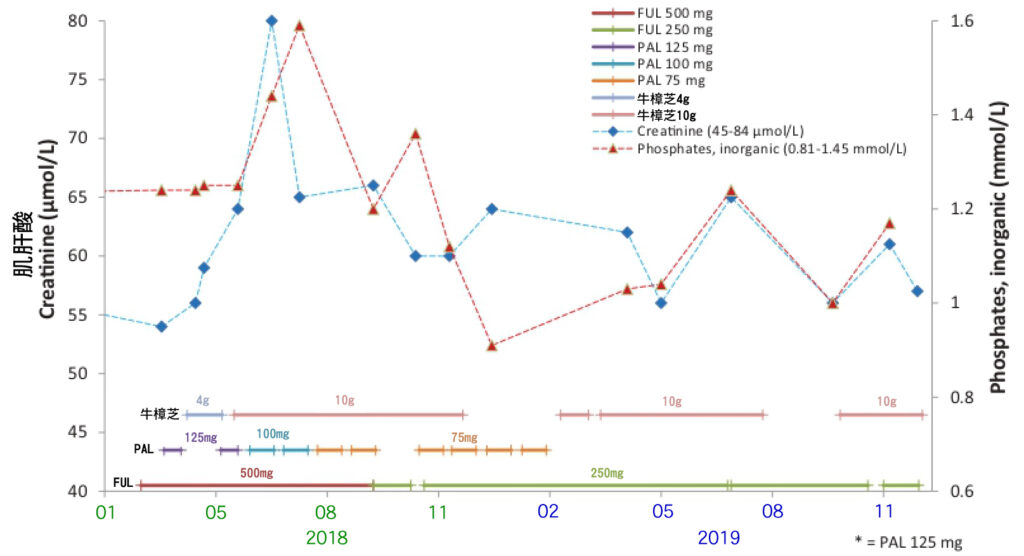
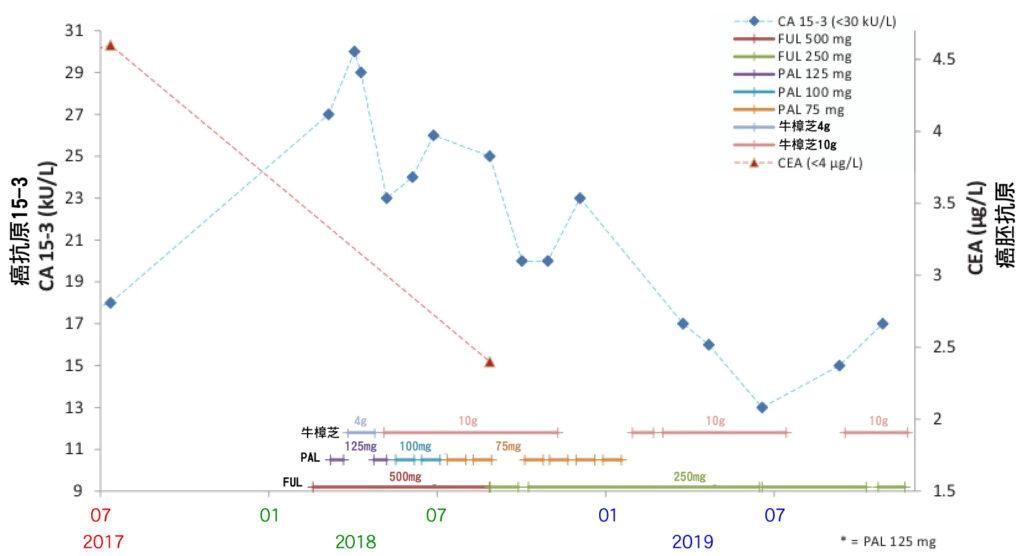
由於PAL加FUL強烈的副作用,患者試圖尋求加入能兼顧生活品質和安全性的其他療法。 2018-4,開始加入每日服用牛樟芝4 g (克),肝功能開始得到改善(圖1)。為了尋求更好的抗癌作用,從2018/5-11,每日服用增量到牛樟芝10 g (克)。腎功能通常是用血清肌酸酐(creatinine)來評估,這段期間腎功能(肌酸酐)保持在正常範圍內(圖2),她的肝功能也保持正常(圖1)。在治療期間,CA15-3和CEA逐步減少(圖3)。在暫停PAL給藥或減少劑量的期間,淋巴細胞(Lymphocyte)和嗜中性白血球(Neutrophils)計數恢復到正常水平(圖4)。
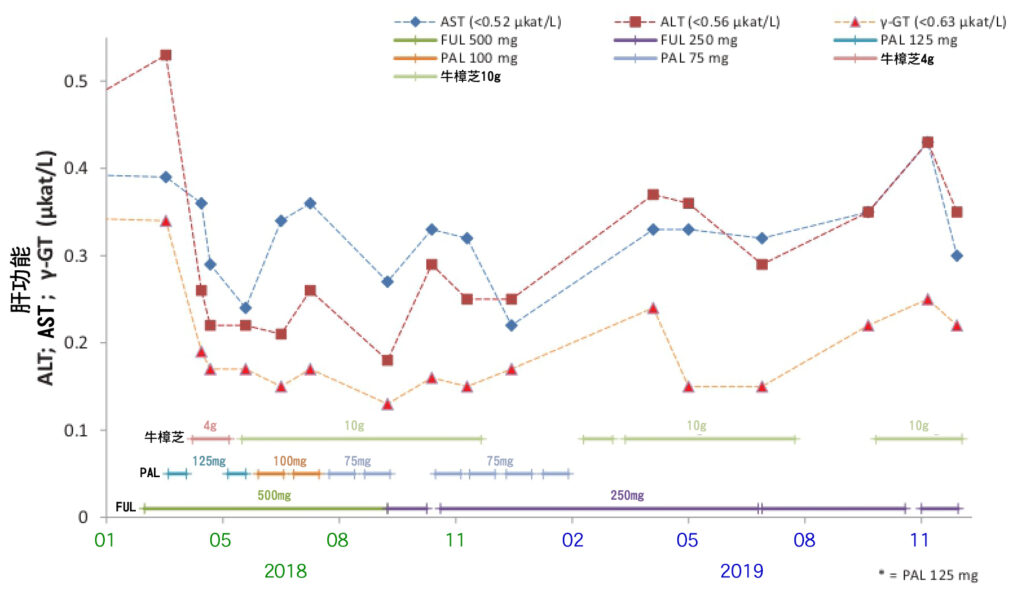
圖1 乳癌患者使用輔助治療藥物並聯合牛樟芝於治療期間的肝功能評估。患者因輔助治療藥物FUL引起的肝毒性造成肝功能ALT偏高,加入牛樟芝4g後得到改善。後續FUL和PAL並搭配牛樟芝的治療期間, 肝功能指數維持在正常區間。
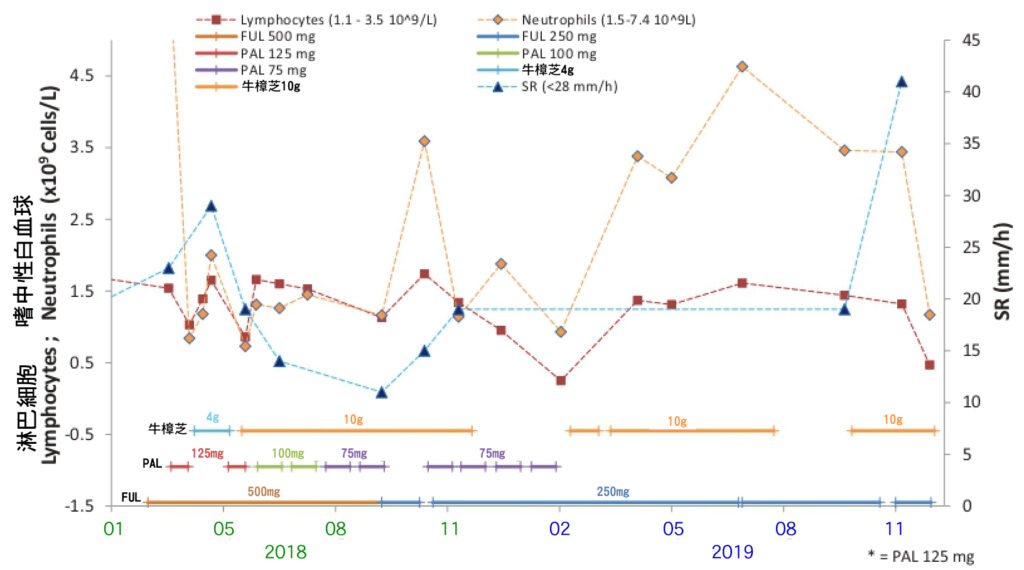
圖4 輔助治療藥物聯合牛樟芝於治療期間的血液學檢測。 牛樟芝在 PAL 劑量小於 100 mg 時可減輕骨髓抑制。當患者接受輔助治療藥物加每天 10 g 牛樟芝時,紅細胞沉降率 (SR) 降至正常範圍內。
2018/6,比利時實驗室根據alpha-N-acetylgalactosaminidase enzyme(nagalase)測試評估了治療效果。結果顯示沒有癌細胞活動。
(4)治療效果更顯著,骨轉移腫瘤縮小
在2018/8,頸椎核磁共振顯示腫瘤已經縮小。2018/9考量副作用,輔助治療劑量被降低(FUL由500mg降至250mg,PAL由125mg降至75mg)。隨著劑量減少,由於骨髓抑制引起的不良反應降低了,但仍未達到正常範圍。
在2018/11,胸部和腹部的CT檢查沒有顯示出任何腫瘤。相較於2018/2,2019/5的MRI檢查顯示轉移瘤已經減小, T1左側最大尺寸從35.2減小到28.1 mm(圖5)。T3右側的腫瘤也從12.0減小到9.9 mm。此外,2019/6的全身未發現任何骨轉移。
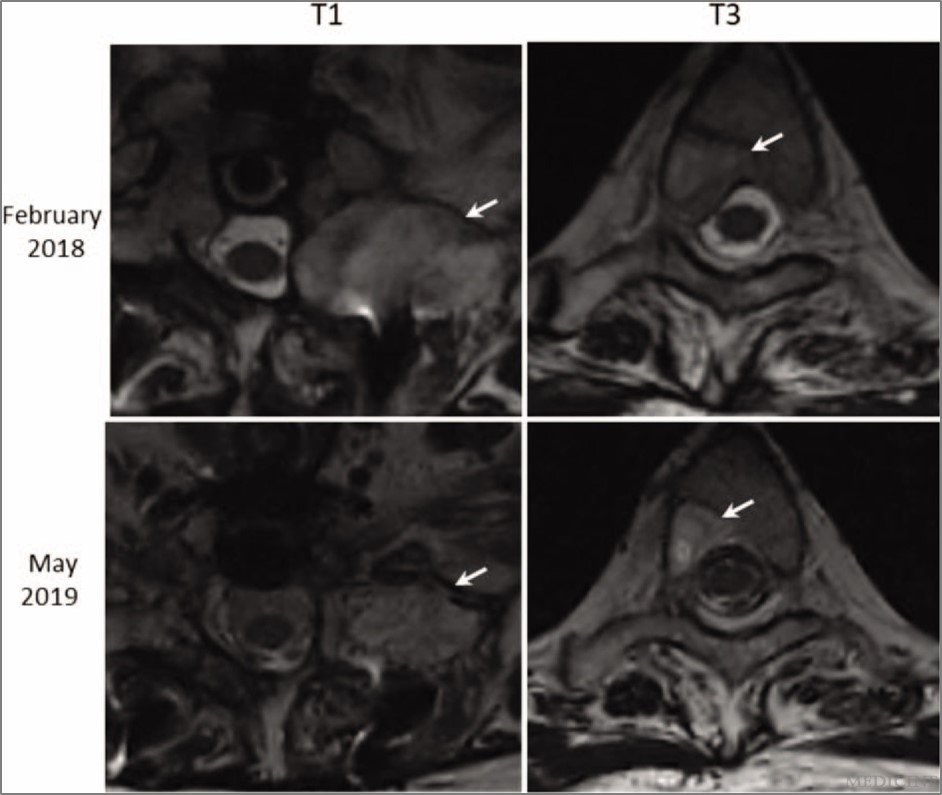
圖5 相較於2018/2,2019/5的MRI檢查顯示轉移瘤已經減小,T1左側最大尺寸從35.2減小到28.1 mm。T3右側的腫瘤也從12.0減小到9.9 mm。
2-4 循環腫瘤細胞檢測(CTCs)持續追蹤治療效果
在後續的追蹤檢查中,我們進行了更多的測試來評估聯合治療(輔助癌症治療搭配牛樟芝)的功效。並紀錄如下:
(1) 2018/10 – 11
循環腫瘤細胞檢測(CTCs, Circulating tumor cells)檢測顯示,在使用輔助治療藥物(FUL 250mg加上PAL 75mg)和每天牛樟芝 10g的情況下,潛在腫瘤細胞的數量下降了近4倍(CTCs從10月的20萬下降到11月5.75萬)(圖6)。
(2) 2018/11~2019/2
患者只接受了FUL 250mg加上PAL 75mg的治療,取消使用牛樟芝。CTCs檢測顯示潛在腫瘤細胞數量從2018/11的5.75萬微幅下降到2019/2的5.5萬,腫瘤細胞的數量只有微小的變化。
(3) 2019/2 – 4
從2019/2開始,患者停止使用PAL,持續接受每天FUL 250mg並加回牛樟芝 10g的治療。CTCs檢測顯示潛在腫瘤細胞數量從2019年2月5.5萬下降到4月的2.75萬。數據清楚地表明,潛在腫瘤細胞的數量顯著減少了一半。 牛樟芝在2 – 4月的短短兩個月內對癌細胞產生了驚人的影響。
(4) 2019/4 – 7
接下來的4-7月三個月,患者繼續接受每天FUL 250mg加上牛樟芝 10g的治療。潛在腫瘤細胞數量持續從2019年4月的2.75萬下降到7月的0.25萬。牛樟芝在4 – 7月的僅三個月內,潛在腫瘤細胞的數量減少了11倍(見圖6)。
(5) 2019/8 – 12
在2019/8,患者停止服用牛樟芝,只接受FUL 250mg治療。2019/10的CTCs檢測顯示,潛在腫瘤細胞數量增加了18倍(從8月的0.25萬增加到10月的4.5萬)。患者立即(10月)恢復服用牛樟芝,繼續與FUL 250mg一起使用。在2019年12月,潛在腫瘤細胞數量再次從2019年10月的4.5萬下降到12月的1萬,潛在腫瘤細胞的數量減少了4倍以上。這表明,與PAL和FUL的輔助治療相比,牛樟芝對潛在腫瘤細胞可能更為有效。
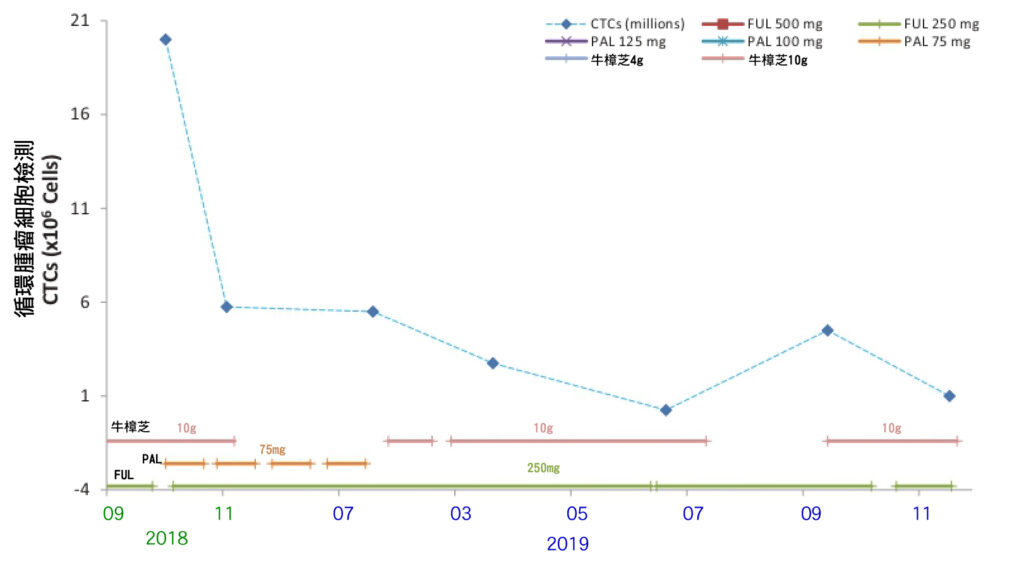
圖6 循環腫瘤細胞(CTCs)分析揭示了FUL 250 mg、PAL 75mg與牛樟芝每天10克,在不同組合下對乳癌的影響。當患者接受每天10克牛樟芝的輔助治療時,CTCs的數量顯著下降。在2019年7月停止牛樟芝後,CTCs數量顯著增加。在重新開始使用牛樟芝和持續FUL治療的2個月期間,我們再次觀察到CTCs水平下降。
3. 結論
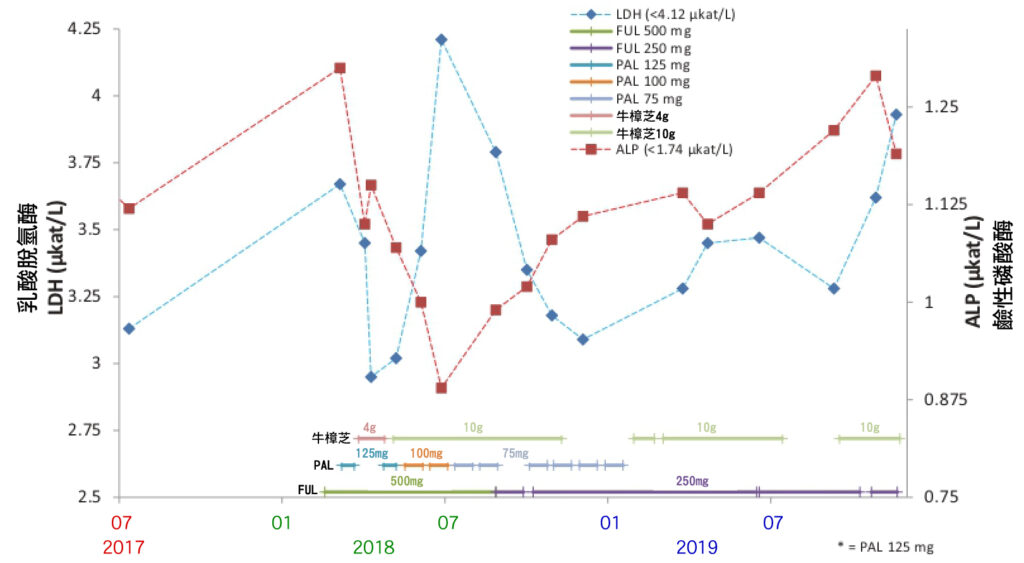
CTCs測試結果可能比用於監測乳癌進展和隨後評估治療效果的影像工具更敏感。根據循環腫瘤細胞(CTCs)測試數據,牛樟芝對活性腫瘤細胞的抗腫瘤功效比PAL加FUL更好。因此,對HR陽性/HER2陰性的轉移性乳癌患者(MBC)來說,在搭配輔助治療藥物(PAL、FUL)下,牛樟芝可能是有效的補充療法。有趣的是,觀察到CA15-3 (癌抗原 15-3)和LDH (乳酸脫氫酶)測值不尋常持續升高,但ALP (鹼性磷酸酶)水平下降,這代表療效顯著導致大量腫瘤細胞死亡(圖7)。
這些效果將有助於提高轉移性乳癌患者的生活質量和無進展生存時間。此外,通過觀察患者正常的肝臟和腎功能,牛樟芝的安全性也得到了證實。因此,牛樟芝可能是一種強效的補充品,可促進乳癌骨轉移的輔助治療的治療效果。
到目前為止,這位轉移性乳癌患者的生活質量仍然很高,後續會繼續追蹤個案患者的狀態至少5年。據我們所知,這是第一份報告案例,顯示牛樟芝對轉移性乳癌患者輔助治療的增強和治療效果。
Long H., Hu C.-T., Prijatelj V. Antrodia cinnamomea is a potentially effective complementary medicine for adjuvant therapy against breast cancer with bone metastasis. Medicine. 2020;99:e20808. doi: 10.1097/MD.0000000000020808.
參考資料
- Lu J. Palbociclib: a first-in-class CDK4/CDK6 inhibitor for the treatment of hormone-receptor positive advanced breast cancer. J Hematol Oncol 2015;8:98. – PMC – PubMed
- McShane TM, Wolfe TA, Ryan JC. Updates on managing advanced breast cancer with palbociclib combination therapy. Ther Adv Med Oncol 2018;10:1–7. – PMC – PubMed
- Turner NC, Slamon DJ, Ro J, et al. Overall survival with palbociclib and fulvestrant in advanced breast cancer. N Engl J Med 2018;379:1926–36. – PubMed
- Khan N, Tyagi SP, Salahuddin A. Diagnostic and prognostic significance of serum cholinesterase and lactate dehydrogenase in breast cancer. Indian J Pathol Microbiol 1991;34:126–30. – PubMed
- Chen B, Dai D, Tang H, et al. Pre-treatment serum alkaline phosphatase and lactate dehydrogenase as prognostic factors in triple negative breast cancer. J Cancer 2016;7:2309–16. – PMC – PubMed
- Pelizzari G, Gerratana L, Basile D, et al. Prognostic role of alkaline phosphatase (ALP) and lactate dehydrogenase (LDH) in metastatic breast cancer (MBC) patients: first clues for cost-effective biomarkers. J Clin Oncol 2018;36: Suppl 15: e13079.
- Keshaviah A, Dellapasqua S, Rotmensz N, et al. CA15-3 and alkaline phosphatase as predictors for breast cancer recurrence: a combined analysis of seven international breast cancer study group trials. Ann Oncol 2007;18:701–8. – PubMed
- Giuliano M, Giordano A, Jackson S, et al. Circulating tumor cells as prognostic and predictive markers in metastatic breast cancer patients receiving first-line systemic treatment. Breast Cancer Res 2011;13:R67. – PMC – PubMed
- Geethangili M, Tzeng YM. Review of pharmacological effects of Antrodia camphorata and its bioactive compounds. Evid Based Complement Alternat Med 2011;2011:212641. – PMC – PubMed
- Chen YC, Liu YC, El-Shazly M, et al. Antrodia cinnamomea, a treasured medicinal mushroom, induces growth arrest in breast cancer cells, T47D cells: new mechanisms emerge. Int J Mol Sci 2019;20:E833. – PMC – PubMed
- Shang KM, Su TH, Lee WL, et al. Novel effect and the mechanistic insights of fruiting body extract of medicinal fungus Antrodia cinnamomea against T47D breast cancer. Phytomedicine 2017;24:39–48. – PubMed
- Long H, Hu CT, Weng CF. Antrodia cinnamomea prolongs survival in a patient with small cell lung cancer. Medicina (Kaunas) 2019;55:E640. – PMC – PubMed